合肥研究院发现成药性良好的第三代FLT3-ITD突变选择性激酶抑制剂
近日,中国科学院合肥物质科学研究院研究员刘青松课题组和刘静课题组在针对FLT3-ITD突变选择性的激酶小分子抑制剂研究方面取得新进展,发现了成药性良好的第三代抑制剂CHMFL-FLT3-362。目前该成果在线发表于国际学术期刊Haematologica。
急性髓性白血病(AML)是由于髓性细胞通过克隆、增殖、异常分化等方式快速渗透至骨髓、血液和其他组织(脾、淋巴结、肝脏等)而引起的造血系统异常的癌症,是成年人最常见的急性白血病,其发病率随年龄增加,且病人生存率较低。研究表明,30%的AML与FLT3激酶突变相关。目前已有若干个FLT3激酶抑制剂被批准用于治疗FLT3-ITD阳性的AML,但这些小分子抑制剂均对野生型FLT3和cKIT激酶具有强烈的抑制作用,在临床上会导致骨髓抑制毒性,并能引发毛发白化病等副作用。正常的野生型FLT3激酶主要在人的骨髓细胞、早期祖细胞、树突状细胞祖细胞和CD34+的造血干细胞中表达,在造血干细胞和祖细胞的增殖和分化中起着重要的作用。因此,为了避免抑制正常野生型FLT3及cKIT激酶所带来的不良影响,开发选择性针对FLT3-ITD突变的小分子抑制剂具有重要的临床价值。
在前期研究中,研究团队已针对FLT3-ITD阳性的急性白血病开发了一系列具有自主知识产权的小分子抑制剂,包括第一代高选择性的FLT3激酶抑制剂HYML-122(目前处于临床I期)、第二代能够克服多种耐药突变的II型激酶抑制剂CHMFL-FLT3-213,以及首个第三代针对FLT3-ITD突变的抑制剂CHMFL-FLT3-335。为了进一步提高其活性、选择性及成药性,研究团队利用计算机辅助药物设计的方法,通过结构优化发展了新型第三代抑制剂CHMFL-FLT3-362。
在蛋白、细胞、动物层次上的研究表明,CHMFL-FLT3-362除了进一步提高了在FLT3-ITD与wt-FLT3等激酶间的选择性之外,与已上市的FLT3抑制剂米哚妥林(Midostaurin)相比,能够显著降低斑马鱼模型的尾部畸形的出现。在连续给药14天的小鼠模型实验中,也没有引起明显的骨髓抑制毒性。这些实验结果进一步验证了FLT3-ITD突变选择性的小分子抑制剂在临床应用上可能具有更好的安全性。此外,CHMFL-FLT3-362在SD大鼠、KM小鼠及Beagle犬中表现出良好的药物代谢动力学性质。在动物体内药效评价方面,在MV4-11细胞皮下移植瘤的小鼠模型上,CHMFL-FLT3-362在150 mg/kg/day的剂量下的抑瘤率(TGI)高达95%,并且在MV4-11细胞原位瘤的小鼠模型上能够显著延长动物的生存时间。
该研究成果获得国家自然科学基金、中科院“个性化药物”先导专项、中科院青促会、博士后基金特别资助项目等的支持。
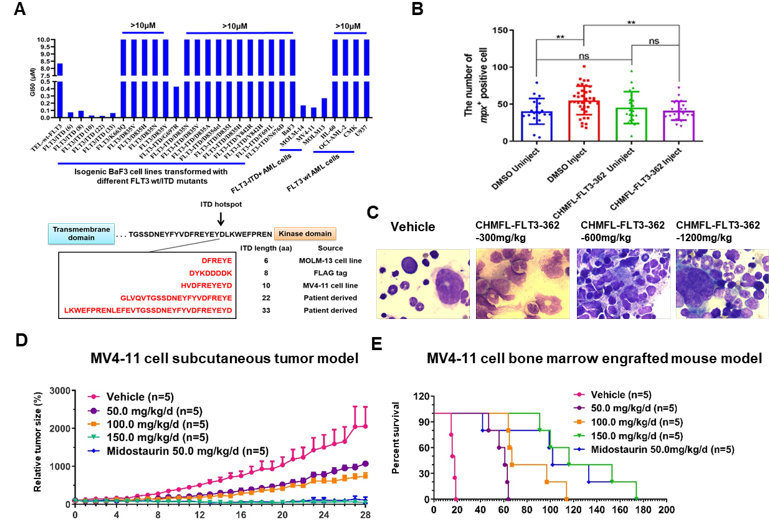
CHMFL-FLT3-362的作用机制及药效数据

